再生医療の現場において、iPS細胞(人工多能性幹細胞)は研究から臨床応用へとそのステージを大きく広げています。山中伸弥教授による発見以来、リプログラミング技術は飛躍的な進化を遂げ、初期化効率の向上や安全性の確保に向けた様々な手法が開発されてきました。しかし、研究員の皆様の中には、樹立効率のばらつきや、臨床グレードへの移行に伴うプロトコルの変更に課題を感じている方も多いのではないでしょうか。
本記事では、iPS細胞の樹立方法における最新のリプログラミング技術に焦点を当て、従来法との比較や具体的な最適化プロトコルについて詳しく解説します。センダイウイルスベクターやエピソーマルベクターなどの特性比較から、フィーダーフリー培養への移行、さらには自動化技術まで、実務に即した有益な情報をお届けします。貴社のラボにおける実験プロセスの改善や、新規プロジェクトの成功に向けた一助となれば幸いです。
iPS細胞樹立の現状と最新トレンド:臨床応用を見据えた非挿入型技術への移行
iPS細胞の樹立技術は、基礎研究段階から臨床応用を見据えた実用化段階へと移行しつつあります。これに伴い、単に細胞ができれば良いという段階から、いかに安全かつ高品質な細胞を効率よく樹立するかが問われるようになりました。ここでは、現在の主流となっている技術トレンドと、臨床応用を前提とした樹立戦略の変化について概観していきましょう。
従来法から最新技術へのパラダイムシフト
かつて主流であったレトロウイルスやレンチウイルスを用いた手法は、ゲノムへのランダムな組み込みによる腫瘍化リスクが懸念されていました。現在では、この課題を克服するために「非挿入型(インテグレーションフリー)」の技術へのパラダイムシフトが起きています。
具体的には、センダイウイルスベクターやエピソーマルプラスミド、合成RNAなどを用いることで、ゲノムを傷つけずに初期化を行う手法が標準となりつつあります。これにより、樹立後の細胞における遺伝的安定性が向上し、創薬スクリーニングや再生医療製品としての信頼性が高まりました。研究現場においても、よりクリーンな背景を持つ細胞を用いることで、実験データの再現性が確保しやすくなるというメリットがあります。
臨床グレード(GMP準拠)での樹立が求められる背景
再生医療等製品としての実用化を目指す場合、GMP(Good Manufacturing Practice)に準拠した製造プロセスが必須となります。これはiPS細胞の樹立段階から求められる要件であり、研究用グレードからのスムーズな移行が課題となるケースも少なくありません。
特に重要なのが、動物由来成分を含まない「Xeno-free」および「Animal-free」な培養環境の構築です。ウシ胎児血清(FBS)やマウスフィーダー細胞の使用を排除し、組成が明確なリコンビナントタンパク質や合成基質を用いることが求められます。最新のトレンドでは、樹立当初からこれらの条件を満たすプロトコルを採用することで、将来的な臨床応用への障壁を最小限に抑える動きが加速しています。
リプログラミング効率と安全性のトレードオフ解消に向けた動き
iPS細胞樹立において、初期化効率(リプログラミング効率)と安全性はしばしばトレードオフの関係にありました。例えば、強力な転写因子であるc-Mycを使用すれば効率は上がりますが、同時に腫瘍形成のリスクも高まります。
しかし、最新の研究ではこのジレンマを解消するための技術革新が進んでいます。c-Mycの代わりにL-Mycを使用したり、p53経路を一時的に抑制することで、安全性を損なわずに効率を維持する手法が確立されてきました。また、培養環境の低酸素化や低分子化合物の添加など、遺伝子導入以外の側面からのアプローチも組み合わされ、高効率かつ安全な樹立が可能になりつつあります。
リプログラミングのメカニズムと初期化因子の最適化
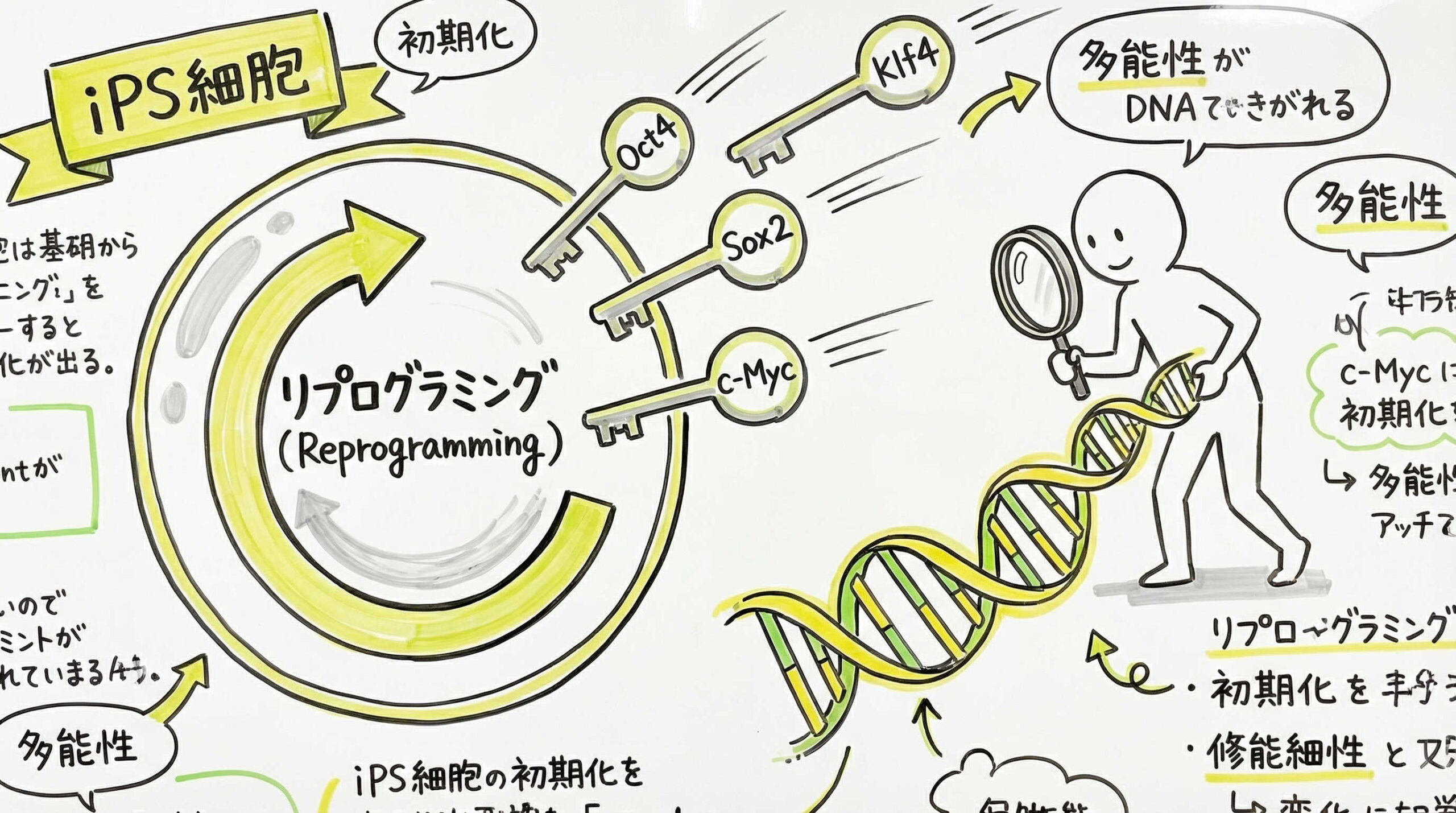
細胞の初期化(リプログラミング)は、分化した体細胞が多能性を獲得する劇的な運命転換のプロセスです。この複雑なメカニズムを分子レベルで理解し、最適な因子を選択することは、樹立成功の鍵となります。ここでは、山中因子をはじめとする初期化因子の役割と、より安全で効率的な代替因子や補助因子の活用について解説します。
山中因子(Oct3/4, Sox2, Klf4, c-Myc)の役割と代替因子
iPS細胞樹立の基本となる山中因子(Oct3/4, Sox2, Klf4, c-Myc)は、相互に作用して多能性ネットワークを活性化させます。Oct3/4とSox2は多能性維持の中核を担い、Klf4とc-Mycはクロマチン構造を変化させて初期化を促進する役割があります。
近年では、これらの因子の機能を代替、あるいは強化する因子が研究されています。
- L-Myc: c-Mycのファミリー因子であり、形質転換活性が低いため、腫瘍化リスクを抑えつつ初期化を誘導できます。
- Esrrb: 多能性ネットワークの安定化に寄与し、因子の組み合わせによってはNanogの代替としても機能します。
これらを適切に組み合わせることで、目的に応じた最適な初期化カクテルを設計することが可能です。
Glis1やL-Mycを用いた腫瘍形成リスクの低減
安全性を最優先する臨床応用において、未分化細胞の混入や腫瘍形成は避けなければならない重大なリスクです。この課題に対し、特定の因子を用いることでリスク低減を図るアプローチが注目されています。
特に注目されるのがGlis1です。Glis1は母性転写因子として知られ、c-Mycの代替として用いることで、初期化効率を損なうことなく、異常な細胞の出現を抑制する効果が報告されています。また、前述のL-Mycとの併用は、現在多くの商用キットや臨床用プロトコルで採用されており、ゲノムの安定性を保ちながら高品質なiPS細胞を樹立するための標準的な戦略となりつつあります。
エピジェネティックな障壁を克服する低分子化合物の活用
体細胞からiPS細胞への変化を阻む大きな壁の一つが、分化細胞特有のエピジェネティックな記憶です。DNAのメチル化やヒストン修飾といったこの障壁を乗り越えるために、低分子化合物の活用が非常に有効です。
代表的な化合物には以下のようなものがあります。
- VPA (Valproic Acid): ヒストン脱アセチル化酵素(HDAC)阻害剤として働き、クロマチン構造を緩めて因子のアクセスを助けます。
- CHIR99021: GSK3阻害剤であり、Wntシグナルを活性化して多能性維持をサポートします。
- SB431542: TGF-βシグナル阻害剤として、間葉系への分化を抑制し初期化を促進します。
これらを培地に添加することで、遺伝子導入量を減らしつつ、リプログラミング効率を劇的に改善することが期待できます。
主要なiPS細胞樹立方法とベクター技術の特性比較
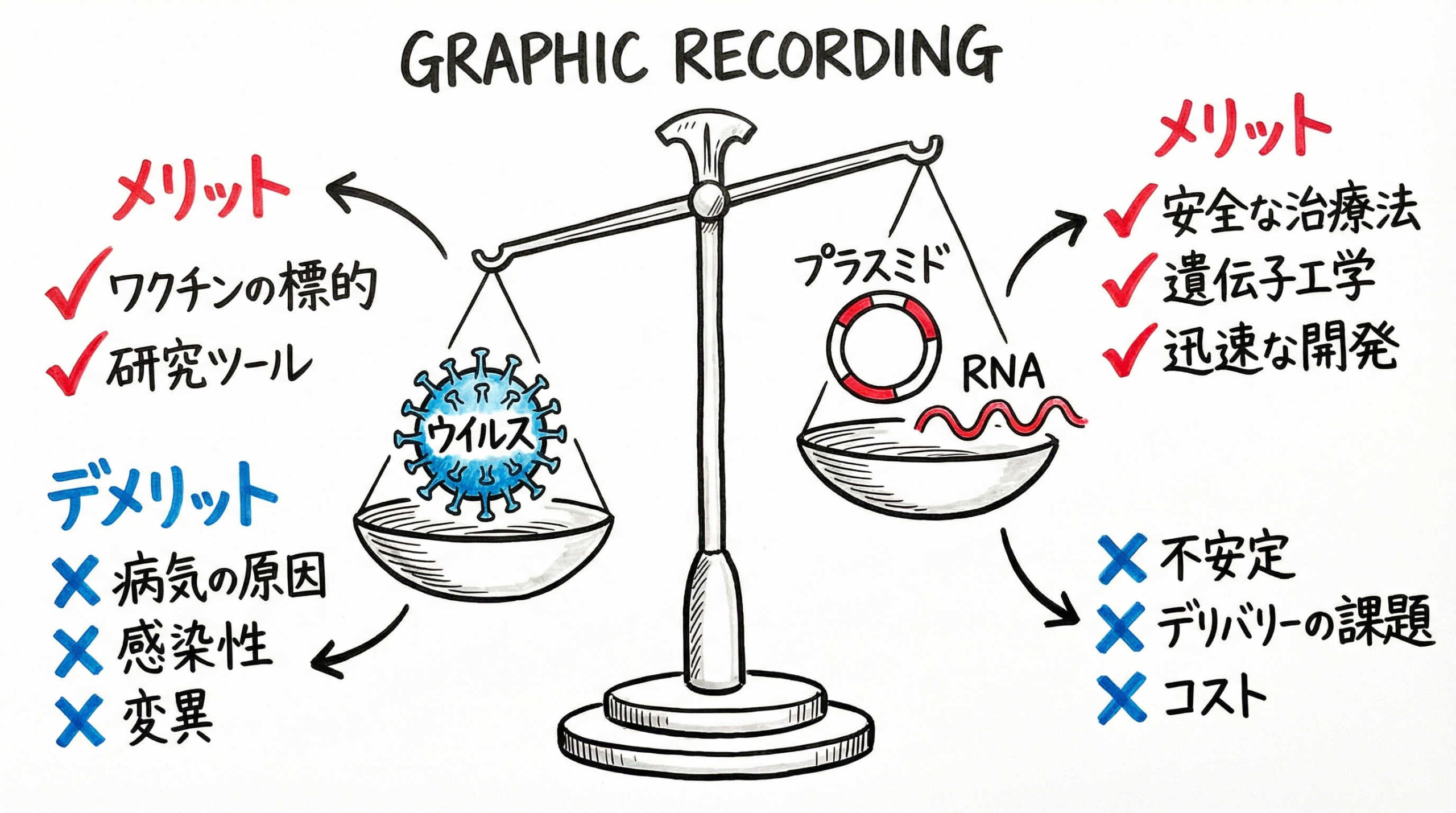
iPS細胞を樹立するためのツールとして、様々なベクター技術が開発されています。それぞれの方法にはメリットとデメリットがあり、研究の目的やリソース、将来の応用範囲に合わせて最適なものを選択する必要があります。ここでは主要な4つの手法について、その特性を比較検討します。
センダイウイルスベクター(SeV):細胞質内複製による高効率樹立
センダイウイルス(SeV)ベクターは、RNAウイルスの一種であり、細胞質内で複製を行うため宿主ゲノムへの組み込みが起こりません。この特徴により、高い安全性を確保しながら、非常に高い導入効率を実現できる点が最大のメリットです。
特に、血液細胞(T細胞やPBMC)からの樹立において優れた効率を発揮します。また、温度感受性変異を導入したベクターを用いることで、樹立後に培養温度を上げるだけでウイルスを完全に除去することが可能です。操作が比較的簡便であり、多くの研究室で第一選択肢として採用されています。
エピソーマルプラスミドベクター:ゲノム非挿入とコストパフォーマンス
エピソーマルプラスミドベクターは、EBウイルス由来の配列を利用して、細胞内でプラスミドとして複製・維持される手法です。この方法もゲノムへの挿入がなく(非挿入型)、ウイルスを用いないため実験室での取り扱いが容易です。
最大の利点はコストパフォーマンスの良さと、一度プラスミドが消失すれば外来因子が残らない「クリーン」な細胞が得られる点です。導入効率はセンダイウイルスに比べてやや劣る場合がありますが、エレクトロポレーション法などの導入技術の改良により、実用十分な効率が得られるようになっています。臨床用iPS細胞ストックの製造などでも実績のある手法です。
合成RNA(mRNA・miRNA)導入法:フットプリントフリーの実現
合成mRNAやmiRNAを直接細胞内に導入する方法は、ベクター由来のDNA配列を一切使用しないため、理論上最もゲノムへの影響が少ない「フットプリントフリー」な手法と言えます。
初期化因子をコードしたmRNAを連日トランスフェクションする必要があり、実験の手間とコストはかかりますが、外来遺伝子の残存リスクをゼロにできる点は大きな魅力です。特に、変異導入のリスクを極限まで排除したい精密な疾患モデル解析や、厳しい安全基準が求められる臨床応用において、その価値が高く評価されています。
タンパク質導入法:遺伝子導入を伴わない安全な手法
初期化因子をリコンビナントタンパク質として直接細胞内に導入する手法です。遺伝子(DNAやRNA)を全く使用しないため、ゲノムへの予期せぬ変異導入のリスクが最も低い、究極的に安全な方法と言えます。
しかしながら、タンパク質の細胞内導入効率が低く、また導入されたタンパク質の安定性も低いため、樹立効率は他の手法に比べて著しく低いのが現状です。大量のタンパク質を精製する必要があるなど技術的なハードルも高く、一般的な研究用途よりは、特殊な安全性が求められる限定的なケースでの利用に留まっています。
目的別ベクター選択のディシジョンツリー
最適なベクターを選択するために、以下の基準を参考にディシジョンツリーをイメージしてみましょう。
- 臨床応用を予定しているか?
- Yes → エピソーマル または SeV(GMPグレード)、mRNA
- No → 次へ
- 樹立効率を最優先するか?
- Yes → センダイウイルス(SeV)
- No → 次へ
- コストを抑えたいか?
- Yes → エピソーマルプラスミド
- 外来因子の完全除去(フットプリントフリー)が必須か?
- Yes → mRNA または 温度感受性SeV
目的に応じて、効率、コスト、安全性のバランスを見極めることが重要です。
樹立効率を最大化する培養条件とプロトコル改善
iPS細胞の樹立成功率は、遺伝子導入法だけでなく、その後の培養環境に大きく依存します。細胞にとってストレスの少ない、かつ多能性を維持しやすい環境を整えることが、高品質なコロニーを得るための近道です。ここでは、樹立効率を最大化するための培養条件とプロトコル改善のポイントを紹介します。
フィーダーフリー培養系への完全移行と基質選択
従来のマウス胎児線維芽細胞(MEF)をフィーダー層とする培養系から、現在はフィーダーフリー培養系への移行が標準化しています。フィーダー細胞のロット間差による影響を排除し、再現性を高めるためです。
基質選択においては、Laminin-511 E8 fragment(iMatrix-511など)が高い評価を得ています。インテグリンとの強い結合により、シングルセル状態からの生存率を劇的に向上させ、コロニー形成を促進します。また、Vitronectinのリコンビナントタンパク質もコストパフォーマンスに優れ、広く利用されています。これらを用いることで、操作の手間を減らしつつ、安定した樹立が可能になります。
低酸素培養(Hypoxia)による初期化効率の向上
通常のインキュベーター内(酸素濃度約20%)に比べ、生体内の環境に近い低酸素条件(2%〜5% O2)での培養は、iPS細胞の樹立効率を向上させることが知られています。
低酸素環境は、細胞内の活性酸素種(ROS)の蓄積を抑え、DNA損傷のリスクを低減します。さらに、p53経路を介した細胞老化やアポトーシスを抑制する効果もあり、初期化プロセスにおける細胞の生存率を高める働きがあります。専用のインキュベーターが必要となりますが、樹立効率にお悩みの場合、導入を検討する価値の高い条件の一つです。
培地組成の最適化とXeno-free/Animal-freeへの対応
培地の組成も日進月歩で進化しています。現在では、StemFitなどの高機能培地が登場し、シングルセル継代への耐性や増殖速度が大幅に改善されました。これらの培地は組成が完全に明らか(Chemically Defined)であり、実験の再現性向上に寄与します。
また、臨床応用を見据え、動物由来成分を含まないXeno-freeや、ヒト由来成分さえも排除したAnimal-freeな培地への対応が進んでいます。樹立段階からこれらの培地を使用することで、将来的な規制対応がスムーズになるだけでなく、異種タンパク質による免疫原性のリスクも回避できます。
樹立したiPS細胞の品質評価とスクリーニング手法
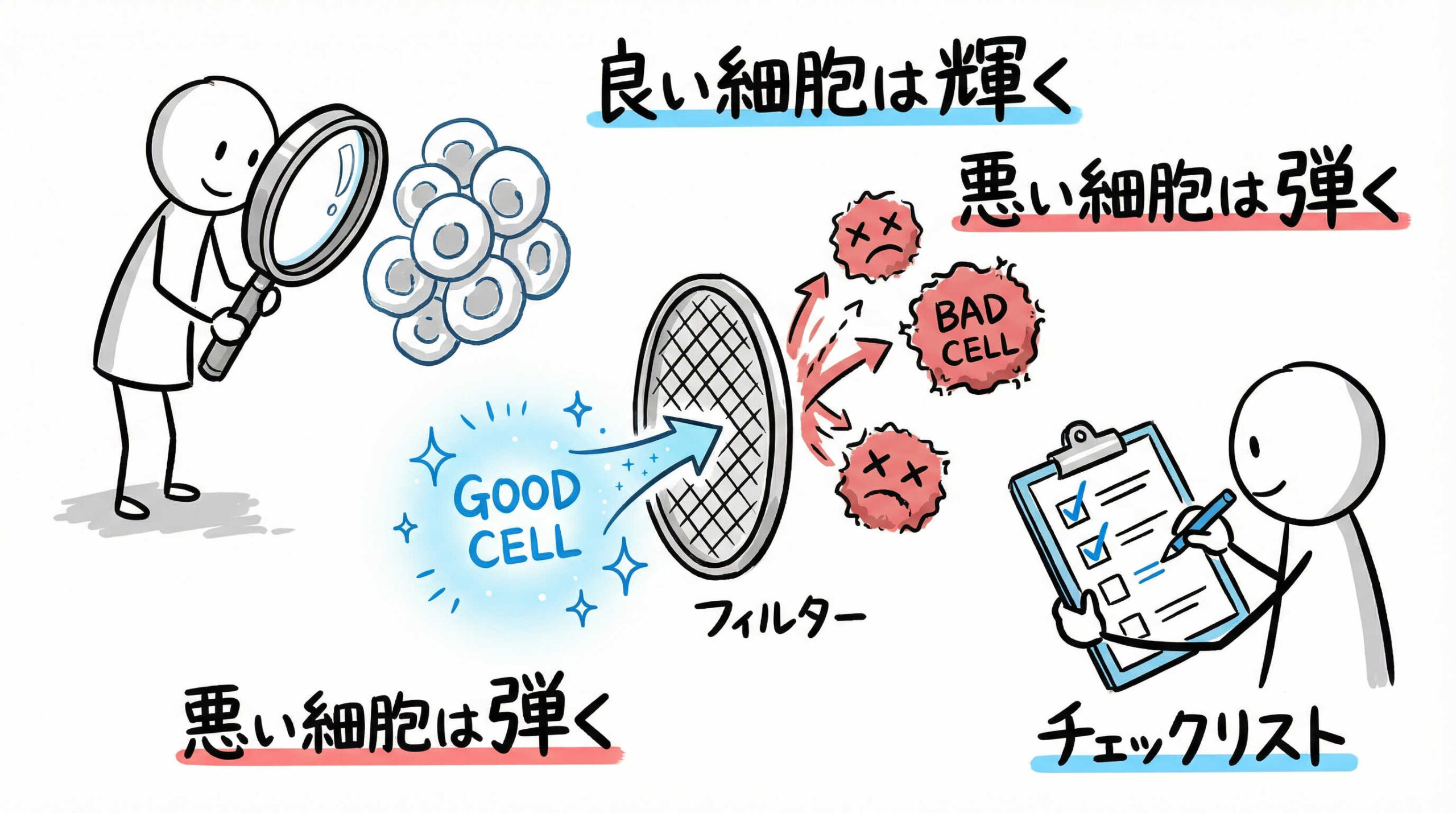
iPS細胞コロニーが出現した後、それらが本当に多能性を持ち、かつ安全な細胞であるかを確認するプロセスは極めて重要です。不適切な細胞を選抜してしまうと、その後の分化誘導実験などがすべて無駄になってしまいかねません。ここでは、樹立したiPS細胞の品質を担保するための評価項目とスクリーニング手法について解説します。
未分化マーカーの発現確認と形態学的評価
最初のスクリーニングとして、コロニーの形態観察と未分化マーカーの発現確認を行います。良質なiPS細胞コロニーは、境界が明瞭で、内部が密に詰まった扁平な形状を示します。
分子レベルでの確認には、アルカリフォスファターゼ(ALP)染色が簡便な一次スクリーニングとして有効です。さらに、免疫染色やフローサイトメトリーを用いて、Tra-1-60, SSEA-4(細胞表面抗原)や、Nanog, Oct3/4(核内転写因子)といった代表的な未分化マーカーが高発現していることを確認します。これらの陽性率が高いクローンを選抜することが、品質確保の第一歩です。
三胚葉分化能の検証(in vitro分化誘導とテラトーマ形成)
多能性幹細胞としての定義を満たすためには、外胚葉、中胚葉、内胚葉のすべてに分化できる能力(三胚葉分化能)を証明する必要があります。
従来は免疫不全マウスに移植してテラトーマ(奇形腫)を形成させる手法がゴールドスタンダードとされてきましたが、動物愛護の観点やコスト、手間の面から、現在はin vitroでの分化誘導(胚様体形成など)による検証が主流になりつつあります。特定の分化誘導培地を用いて三胚葉それぞれのマーカー遺伝子の発現上昇を確認することで、より迅速かつ定量的に分化能を評価することが可能です。
核型解析とCopy Number Variation(CNV)の確認
リプログラミングや長期培養の過程で、染色体異常(カリオタイプ異常)やコピー数多型(CNV)といったゲノム異常が生じることがあります。これらは実験結果に悪影響を及ぼすだけでなく、腫瘍化の原因ともなるため、厳密なチェックが必要です。
基本的なG-band分染法による核型解析で染色体数の異常や大きな構造異常を確認します。さらに、より微細な欠失や重複を検出するために、マイクロアレイ解析(SNPアレイなど)や次世代シーケンサー(NGS)を用いた解析を行うことが推奨されます。定期的なモニタリングを行うことで、細胞の品質を一定に保つことができます。
残存ベクターの除去確認(温度感受性ベクター等の処理)
非挿入型のベクターを使用したとしても、細胞内にベクター由来の成分が残存している可能性があります。特に臨床応用や厳密な実験においては、外来因子が完全に消失していることの証明が求められます。
温度感受性センダイウイルスベクターを用いた場合は、培養温度を上げた後にRT-PCR等でウイルスRNAの消失を確認します。エピソーマルベクターの場合も、継代を重ねることでプラスミドが希釈・消失したことをPCRで確認します。「Vector-free」であることを確認して初めて、樹立完了とみなすことができます。この工程を確実に実施することが、信頼性の高いiPS細胞ライン確立の仕上げとなります。
自動化技術と将来展望:再現性の担保とコスト削減
iPS細胞技術の普及に伴い、熟練した技術者による手作業への依存からの脱却が求められています。樹立プロセスの再現性を高め、コストを削減するために、自動化技術やAIの導入が急速に進んでいます。これからのiPS細胞製造のスタンダードとなりうる、先端技術の展望について触れておきましょう。
自動培養装置を用いた樹立プロセスの標準化
iPS細胞の培養、特に樹立プロセスは繊細な操作を要するため、担当者によって結果にばらつきが出やすいのが課題でした。これを解決するため、培地交換や継代操作を自動で行う自動培養装置の導入が進んでいます。
ロボットアームや分注機を組み合わせたシステムにより、24時間365日、均一な条件での培養が可能となります。これにより、ヒューマンエラーを排除し、大量の検体を同時に処理することが現実的になってきました。プロセスの標準化は、多施設間でのデータ比較や、大規模な細胞バンク構築において不可欠な要素となっていくでしょう。
AIによるコロニー選抜と品質判定の効率化
良質なiPS細胞コロニーを見極める「目利き」の作業も、AI(人工知能)によって代替されつつあります。ディープラーニングを用いた画像解析技術により、熟練者の判断基準を学習したAIが、顕微鏡画像から自動的に良好なコロニーを識別します。
さらに、非侵襲的な画像データから分化能や増殖速度を予測するアルゴリズムも開発されています。これにより、品質評価にかかる時間とコストを大幅に圧縮し、客観的な指標に基づいた効率的なスクリーニングが可能になります。AI技術は、iPS細胞製造の産業化を加速させる強力なエンジンとなることが期待されています。
まとめ

iPS細胞の樹立技術は、初期のウイルスベクター法から、より安全で効率的な非挿入型技術へと大きな進化を遂げました。センダイウイルスやエピソーマルベクター、さらには合成RNAを用いた手法の確立により、臨床応用にも耐えうる高品質な細胞の樹立が可能になっています。また、フィーダーフリー培養や低酸素条件、Xeno-free培地の活用など、周辺技術の最適化も進み、研究の再現性と効率は飛躍的に向上しました。
今後は、自動培養やAIによる品質判定といったテクノロジーの融合により、手技の属人性が解消され、より標準化されたプロセスが普及していくでしょう。最新の技術トレンドを把握し、自社の研究目的に最適なプロトコルを選択・導入することは、研究開発のスピードアップと競争力強化に直結します。ぜひ、本記事で紹介した情報を、貴社のラボでの実験系改善にお役立てください。
iPS細胞の樹立方法と最新リプログラミング技術についてよくある質問
iPS細胞の樹立やリプログラミング技術に関して、研究現場でよく寄せられる質問をまとめました。
- Q1. 現在、最も効率が良いとされるiPS細胞の樹立方法はどれですか?
- 一般的に、センダイウイルスベクター(SeV)を用いた方法が最も樹立効率が高いとされています。特に血液細胞など、樹立が難しい細胞種に対しても高い効率を発揮します。
- Q2. 臨床応用(GMPグレード)を目指す場合、どのベクターを選択すべきですか?
- エピソーマルプラスミドベクターや、GMP製造されたセンダイウイルスベクター、あるいは合成RNA(mRNA)法が推奨されます。いずれもゲノムへの挿入がない(非挿入型)ことと、動物由来成分を含まない(Xeno-free)プロセスで実施できることが重要です。
- Q3. フィーダー細胞(MEF)は必ず必要ですか?
- いいえ、現在はフィーダーフリー培養が主流です。Laminin-511 E8 fragment(iMatrix-511など)やVitronectinなどの基質を用いることで、フィーダー細胞なしでも安定して樹立・維持培養が可能です。
- Q4. iPS細胞の樹立にはどのくらいの期間がかかりますか?
- 使用する細胞種やベクターによりますが、遺伝子導入からコロニーが出現するまで約3〜4週間かかります。その後、コロニーのピックアップ、増幅、品質評価(ベクター除去確認など)を含めると、樹立完了までにはトータルで2〜3ヶ月程度を見込んでおくのが一般的です。
- Q5. 樹立コストを削減するためのポイントはありますか?
- 自作可能なエピソーマルプラスミドベクターを使用することで試薬コストを抑えられます。また、リコンビナントタンパク質を用いた基質の最適化や、培地交換の頻度を減らせる高機能培地(週末の培地交換不要なタイプなど)を採用することで、人件費を含めたトータルコストの削減が可能です。